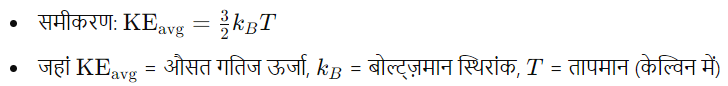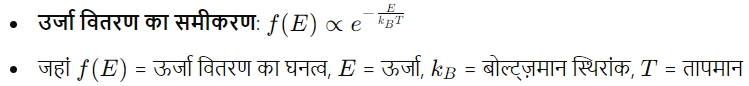Skip to content
परिचय (Introduction)
- अणुगति सिद्धांत: गैसों के अणुओं के गति और उनके गुणधर्मों के बीच संबंध का अध्ययन।
- उद्देश्य: गैसों की विभिन्न भौतिक विशेषताओं को अणुओं की गति के आधार पर समझना।
गैस के अणुओं की गति (Molecular Motion in Gases)
- अणुओं की गति: गैस अणु तेजी से और यादृच्छिक गति में होते हैं।
- गति का प्रकार:
- अनियमित गति (Random Motion): अणु किसी विशेष दिशा में नहीं चलते।
- मध्यवर्ती गति (Average Velocity): सभी अणुओं की गति का औसत वेग।
गैसों का दबाव (Pressure of a Gas)
- दबाव का परिभाषा: गैस अणुओं द्वारा दीवारों पर लगाए गए बल का माप।
- गैस के अणुओं की टकराहट: प्रत्येक टकराहट से दीवार पर एक बल लगता है, जो दबाव का कारण बनता है।
- अणुगतिक दबाव समीकरण (Kinetic Pressure Formula):
- समीकरण: P = 1/3 ρv²
- जहां P = दबाव, ρ = गैस का घनत्व, v = अणुओं की रूट-मीन-स्क्वायर वेग (rms velocity)
आदर्श गैस के नियम (Ideal Gas Laws)
- आदर्श गैस का समीकरण (Ideal Gas Law):
- समीकरण: PV = nRT
- जहां P = दबाव, V = आयतन, n = मोल की संख्या, R = गैस स्थिरांक, T = तापमान (केल्विन में)
- गैस का आदर्श व्यवहार: आदर्श गैस का व्यवहार विशिष्ट परिस्थितियों में होता है, जैसे बहुत कम दाब और उच्च तापमान पर।
गति की औसत ऊर्जा (Average Kinetic Energy)
- औसत गति ऊर्जा: गैस अणुओं की औसत गतिज ऊर्जा:
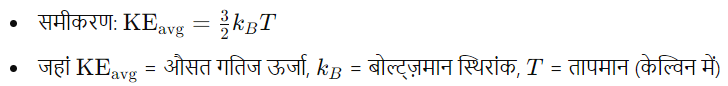
बोल्ट्ज़मान वितरण (Boltzmann Distribution)
- बोल्ट्ज़मान वितरण: गैस अणुओं की ऊर्जा वितरण:
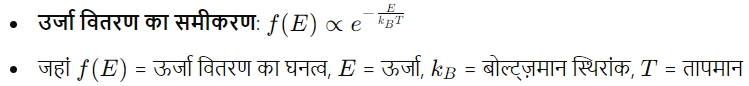
गति का प्रकार (Types of Molecular Motion)
- अनुवांशिक गति (Translational Motion): अणुओं की सीधी रेखा में गति।
- कंपन गति (Vibrational Motion): अणुओं के बीच बलों के कारण कंपन।
- घूर्णन गति (Rotational Motion): अणुओं का अपने धुरी पर घूमना।
गैसों के आदर्श व्यवहार में सच्चाई (Real Gas Behavior)
- वास्तविक गैसें: आदर्श गैस के नियमों का पूर्ण रूप से पालन नहीं करतीं।
- वान डेर वाल्स का समीकरण (Van der Waals Equation): वास्तविक गैसों के लिए सुधारित समीकरण:
- (P + a/V²) (V − b) = nRT
- जहां a और b = गैस की विशिष्ट गुणांक
गैसों की गर्मी की क्षमता (Heat Capacity of Gases)
- गैस की गर्मी की क्षमता: गैस की मात्रा या दबाव पर निर्भर करती है।
- वह गर्मी की क्षमता: CV = 3/2 nR (वॉल्यूम पर स्थिर)
- वह गर्मी की क्षमता: CP = 5/2 nR (दबाव पर स्थिर)
महत्वपूर्ण परिभाषाएँ (Important Definitions)
- अणुगति सिद्धांत (Kinetic Theory of Gases): गैसों के अणुओं के गति और गुणधर्मों का सिद्धांत।
- आदर्श गैस (Ideal Gas): एक काल्पनिक गैस जो आदर्श गैस के नियमों का पालन करती है।
- औसत गति ऊर्जा (Average Kinetic Energy): गैस अणुओं की औसत गतिज ऊर्जा।
- बोल्ट्ज़मान वितरण (Boltzmann Distribution): गैस अणुओं की ऊर्जा वितरण।